
Atomistique: cours, Résumés, Exercices et examens corrigés
I- Généralités sur l’atome
L’atome est l’élément fondamental de la matière, à cause de sa grande réactivité, n’existe pratiquement pas à l’état libre dans les conditions expérimentales ordinaires sauf pour les gaz parfaits.
L’atome est composé d’un noyau, lui-même constitué de protons et de neutrons ainsi que d’un cortège d’électrons qui évoluent autour de ce noyau (les protons et les neutrons sont des nucléons). Un atome est électriquement neutre.
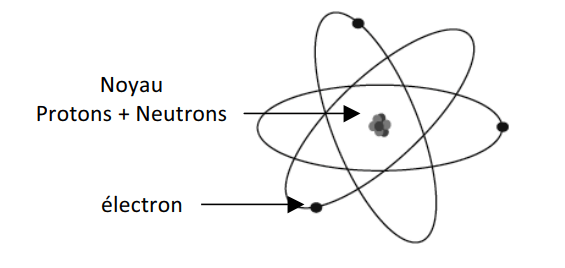
L’atome est caractérisé par son symbole : AZX
Un élément chimique est caractérisé par son numéro atomique Z.
En perdant des électrons, les atomes se transforment en entités chargées positivement : on les appelle des cations et on les symbolise par la notation Xn+ où n est le nombre d’électrons perdus.
En gagnant des électrons, les atomes se transforment en entités chargées négativement : on les appelle des anions et on les symbolise par la notation Xn- où n est le nombre d’électrons perdus.
I-1. L’unité de masse atomique
L’unité de masse atomique (u) est l’unité pratique de mesure du poids d’un atome, la référence est l’atome126C qui pèse 12u. On estime ainsi que 1u ~ mproton ~ mneutron.
On peut ainsi définir le nombre d’Avogadro qui est le nombre d’atomes de 126C contenus dans 12 grammes de 126C: NA = 6,022.1023 mol-1.
Une mole est composée de 6,022.1023 entités (molécules, atomes etc…)
I-2. La masse molaire
La masse molaire M d’une entité est la masse d’une mole de cette entité : pour une mole d’atome AZX M ~ A g.mol-1.
Par exemple : M (126C) = 12 g.mol-1 ; M (147N) = 14 g.mol-1.
I-3. Les isotopes
Les isotopes d’un élément sont des nucléides qui ont le même numéro atomique (Z), mais des nombres de masse (A) différents.
Z est le nombre de protons permet d’identifier la nature de l’élément et donc ses propriétés chimiques.
Des isotopes ont donc un même nombre de protons mais un nombre différent de neutrons.
Par exemple : 126C, 136C, 146C.
Le 126C a 6 neutrons, 136C a 7 neutrons et 146C a 8 neutrons.
II- Structure électronique de l’atome
De nombreuses modélisations de la structure électronique des atomes ont été proposées au cours de l’histoire, nous ne verrons que les deux plus récentes qu’il faut absolument connaître.
II-1. Modèle de Bohr
Ce modèle ne s’applique qu’aux atomes mono électroniques, donc l’atome d’hydrogène et les hydrogénoïdes, c’est-à-dire les ions qui n’ont qu’un seul électron (He+, Li2+ …).
Dans ce modèle, Bohr postule que l’électron ne peut se situer que sur certaines orbites autour de l’atome dans lesquelles l’électron a une énergie précise. L’électron ne peut passer d’une orbite à une autre qu’en absorbant de l’énergie (absorption ou excitation) ou en émettant de l’énergie (émission ou désexcitation).
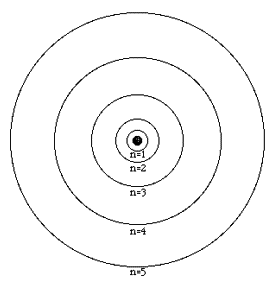
On numérote les couches grâce au nombre quantique n qui permet de déterminer sur quelle couche l’électron se trouve. La couche la plus proche du noyau, et donc la plus stable énergétiquement, est la couche numéro 1 (n = 1), lorsqu’il est sur cette couche l’électron est dans son état fondamental.
Le nombre quantique n est un entier naturel, c’est-à-dire qu’il prend toutes les valeurs entières de 1 à l’infini : n = 0 ; 1 ; 2 …
II-2. Modèle de Schrödinger
Ce modèle s’applique aux atomes poly électroniques et fait intervenir quatre nombres quantiques pour décrire les électrons :
- Le nombre quantique principal qui définit le numéro de la couche sur laquelle se trouve l’électron ainsi que son énergie. n est un entier naturel : n = 1 ; 2 ; 3…
- l, le nombre quantique secondaire qui définit la sous-couche électronique et décrit la forme de l’orbitale dans laquelle se trouve l’électron : 0 ≤ l ≤n-1 :
- ml, le nombre quantique magnétique qui définit l’orientation de l’orbitale dans le champ magnétique : -l ≤ ml ≤ +l, il permet de trouver le nombre d’orbitales par sous-couche :
- ms, le nombre quantique de spin qui décrit la rotation de l’électron sur lui-même : s = + ½ ; – ½
Les trois premiers nombres définissent une orbitale atomique (n, l, m), et cette fonction d’onde (n, l, m) permet de définir la probabilité de présence de l’électron : 2 = P(présence). C’est le volume dans lequel on aura 95% de chances de trouver l’électron, selon le nombre l ces orbitales auront des formes différentes.
A partir de ces nombres quantiques, on peut énoncer la configuration électronique des atomes en utilisant 2 principes :
II-2-1. Le principe d’exclusion de Pauli :
Dans un atome, il ne peut y avoir deux électrons avec les 4 mêmes nombres quantiques.
Ainsi, dans une orbitale définie par les trois mêmes nombres quantiques, il ne peut y avoir au maximum que deux électrons, donc par sous-couche, on a au maximum :
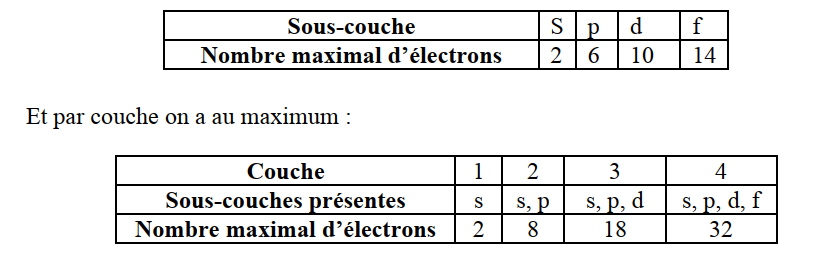
Nombre maximum d’électrons par couches = 2n2
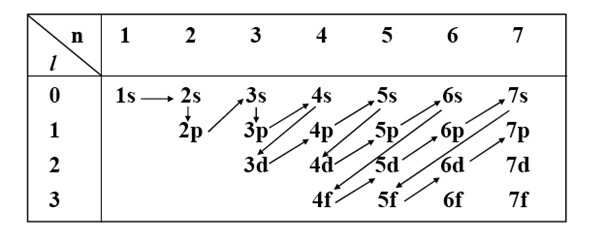
II-2-2. Le principe de Klechkowski
L’ordre de remplissage des sous-couches se fait à partir de la moins énergétique vers la plus énergétique, l’énergie des sous-couches est définie à partir du (n + l) minimal et en cas d’égalité le n le plus petit l’emporte :
Le tableau périodique des éléments
Les éléments sont disposés dans le tableau et classés par Z croissant :
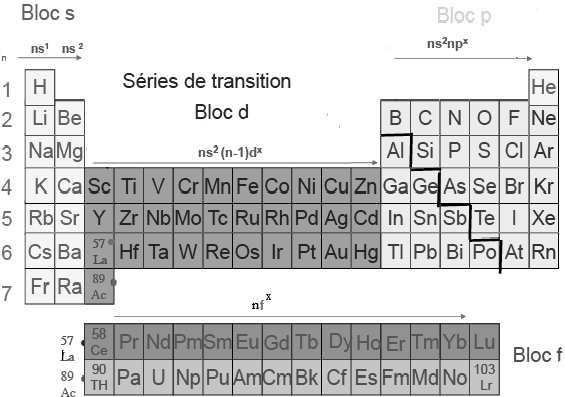
Dans le tableau périodique une ligne s’appelle période, tous les éléments de la même période ont le même n terminal. Une colonne s’appelle famille, tous les éléments de la même famille ont la même configuration électronique externe, donc le même nombre d’électrons de valence et ont par conséquent des propriétés chimiques voisines. Il est nécessaire de retenir les éléments des 3 premières lignes ainsi que les noms et caractéristiques des familles suivantes :
- Les alcalins, configuration externe en ns1 auront tendance à perdre un électron.
- Les alcalino-terreux, configuration externe en ns2 auront tendance à perdre deux électrons.
- Les halogènes, configuration externe en ns2np5 auront tendance à gagner un électron.
- Les gaz rares, configuration externe en ns2np6 ne se lient pas et ne perdent ni ne gagnent d’électrons.
Les atomes ont 4 caractéristiques qui varient selon leur emplacement dans le tableau périodique :
- Le rayon atomique
- L’énergie d’ionisation
- L’affinité électronique
- L’électronégativité
I- Rayon atomique
Le rayon atomique augmente de haut en bas dans une famille. Plus il y a de couches électroniques, plus le rayon atomique est élevé.
r(Br) > r(F)
Le rayon atomique augmente de droite à gauche dans une période. Plus le noyau est chargé, plus il attire les électrons périphériques et plus il sera compact donc petit.
r(F) < r(Li)
Le rayon d’un anion est supérieur à celui d’un atome neutre qui est lui-même supérieur à celui d’un cation : r(A-) > r(A) > r(A+)
Pour plus de détails télécharger les documents ci-dessous:
Liens de téléchargement des cours sur l’Atomistique
Cours sur l’Atomistique N°1
Cours sur l’Atomistique N°2
Cours sur l’Atomistique N°3
Cours sur l’Atomistique N°4
Cours sur l’Atomistique N°5
Cours sur l’Atomistique N°6
Cours sur l’Atomistique N°7
Liens de téléchargement des Résumés sur l’Atomistique
Résumé sur l’Atomistique N°1
Résumé sur l’Atomistique N°2
Résumé sur l’Atomistique N°3
Résumé sur l’Atomistique N°4
Liens de téléchargement des exercices corrigés sur l’Atomistique
Exercices corrigés sur l’Atomistique N°1
Exercices corrigés sur l’Atomistique N°2
Exercices corrigés sur l’Atomistique N°3
Exercices corrigés sur l’Atomistique N°4
Exercices corrigés sur l’Atomistique N°5
Exercices corrigés sur l’Atomistique N°6
Liens de téléchargement des examens corrigés sur l’Atomistique
Examens corrigés sur l’Atomistique N°1
Examens corrigés sur l’Atomistique N°2
Examens corrigés sur l’Atomistique N°3
Examens corrigés sur l’Atomistique N°4