
La liaison covalente c’est la mise en commun de deux électrons (doublet de liaison) : les atomes qui s’associent fournissent chacun un électron de valence et la liaison est localisé entre les deux atomes.
Les atomes forment des liaisons pour acquérir la configuration électronique des gaz rares (règle de l’octet).
Pour acquérir la configuration d’un gaz rare, le chlore par exemple, a deux solutions: soit il arrache un électron à un autre atome (par exemple le Na), soit il met en commun son électron avec celui d’un autre atome de chlore.
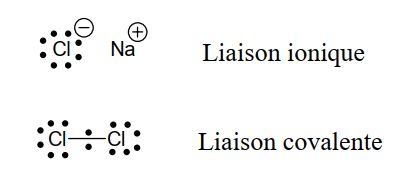
Selon l’atome auquel il est lié, l’atome de chlore peut former soit une liaison ionique soit une liaison covalente. Il doit cette propriété à sa position sur le tableau périodique.
Le carbone, par contre, n’a pas le choix : perdre 4 électrons pour ressembler à l’hélium ou gagner 4 pour ressembler au néon lui coûte trop d’énergie, seules les liaisons covalentes lui sont autorisées.
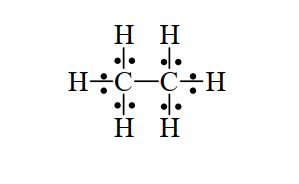
Exemple : CH3-CH3 (éthane)
I- Exemples de structures basées sur les liaisons covalentes
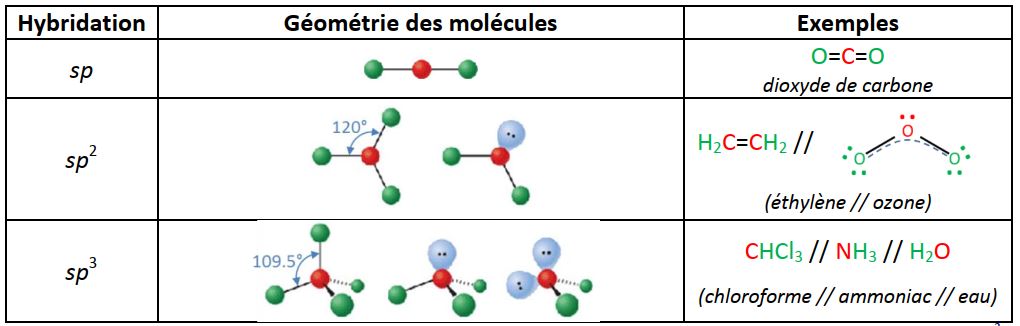
La majorité des molécules de petite taille présente des liaisons covalentes. Les exemples les plus simples sont les molécules diatomiques homonucléaires telles H2, O2, N2… Des constructions moléculaires de géométrie plus complexe peuvent également être obtenues à partir d’orbitales atomiques hybrides, au sein de molécules de petite taille ou de macromolécules (chaines carbonées dans les cristaux liquides et polymères).
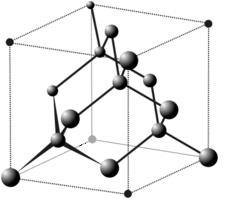
Le diamant, le silicium et le germanium sont les archétypes des cristaux covalents.
Ils cristallisent dans une maille cubique contenant (8 × 1 /8 + 6 × 1 /2 + 4) = 8 atomes. Ceux-ci occupent les sommets et centres des faces, ainsi que les positions (1 /4 1/ 4 1 /4), (3/ 4 3/ 4 1 /4), (3 /4 1/4 3 /4), et (1 /4 3 /4 3 /4).
Les atomes sont en coordinence tétraédrique : ils possèdent 4 premiers voisins situés à égale distance, les axes de liaison faisant des angles de 109.5° deux à deux. Cet arrangement structural reflète l’établissement des liaisons covalentes entre orbitales hybrides de type sp3
II- Liaison covalente selon LEWIS (Forte énergie)
LEWIS considère que les atomes cherchent à acquérir la configuration électronique ns2 np6 (octet). Considérons les atomes de la ligne n=2 (Li, Be, B, C, N, O, F, Ne). Seul le néon Ne à la configuration requise.
Il manque au Fluor un électron pour l’obtention de la configuration, alors le fluor établira une liaison covalente. Il manque 2 électrons à l’oxygène pour avoir la configuration ns2 np6, l’oxygène établira deux liaisons covalentes. En faisant le même raisonnement pour l’azote et le carbone, on trouve qu’ils établiront respectivement 3 et 4 liaisons covalentes. Notons que la valence d’un atome est le nombre de liaisons que l’atome pourra former avec d’autres éléments, il sera fréquent de trouver dans la littérature que la valence des halogènes est 1, celle des oxygènes est 2, celle des azotées est 3 et enfin celle du carbone 4. Signalons que les atomes lourds peuvent réagir différemment.
Si on considère les premiers atomes (Li, Be, B), il sera facile de trouver que la valence du lithium est 1, celle du Béryllium est 2 et celle du Bore est 3.
Dans cette classification périodique simplifiée ci-dessous les écritures de LEWIS de certains atomes.
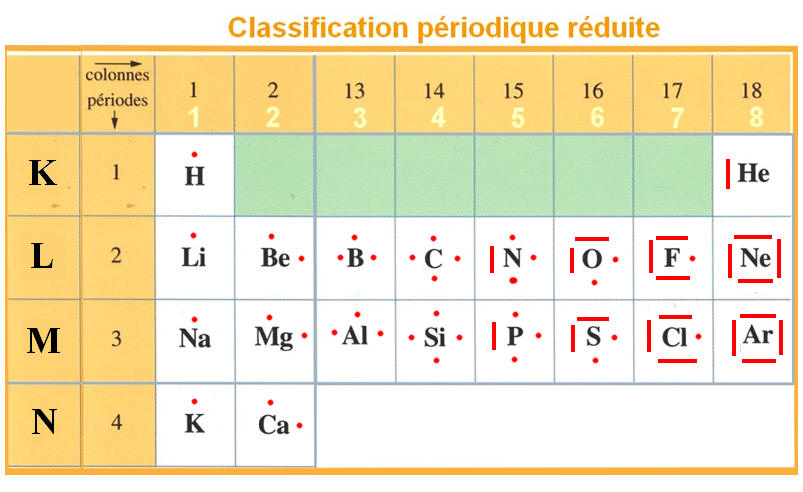
II-1 Notion de Valence
C’est le nombre de liaisons que fait un atome dans une molécule, Elle correspond en général au nombre d’électrons célibataires de l’atome considéré. La valence normale d’un élément se déduit du schéma de Lewis atomique et donc de sa configuration électronique.
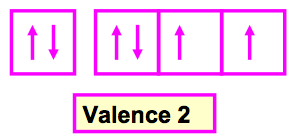
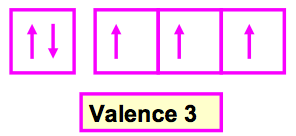
II-2 Excitation d’un atome
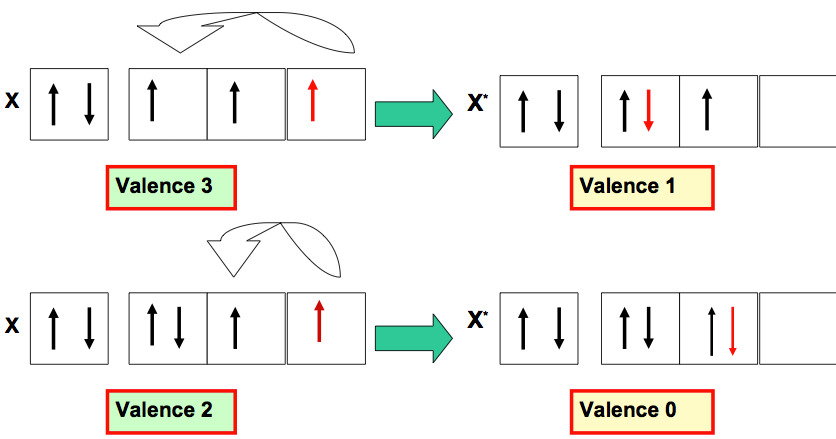
La valence d’un atome peut être augmentée ou diminuée par excitation de l’atome :
- Si le nombre d’électrons célibataires augmente la valence augmente.
- Si le nombre d’électrons célibataires diminue la valence diminue.
Exemples d’augmentation de Valence
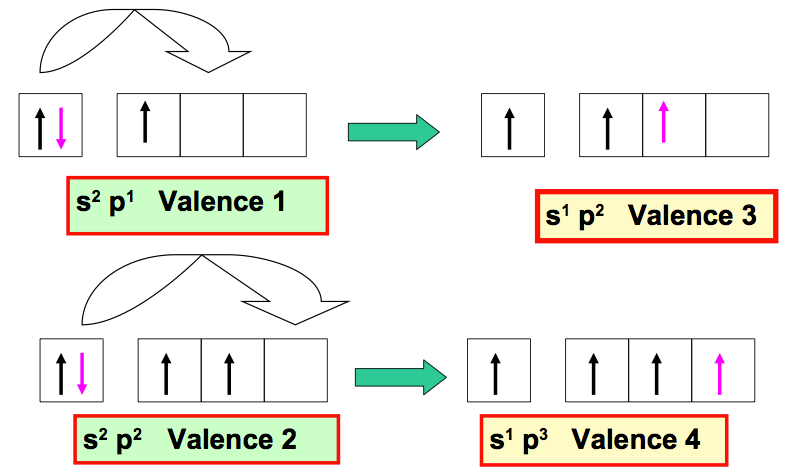
Exemples de Diminution de Valence
Remarque :
L’excitation d’un atome pour augmenter sa valence n’est possible que si celui-ci possède simultanément des doublets électroniques et des cases quantiques vides accessibles sur sa couche de valence. Cela n’est pas toujours le cas, et il ne sera donc pas toujours possible d’augmenter la valence d’un atome.
Les éléments de la deuxième période ne possédant pas de sous niveaux d.
Exemple : Atome de fluor (F)
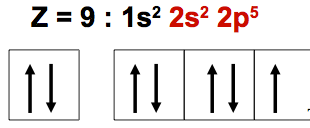
Pas d’excitations possibles : pas de sous niveaux d
Pour plus de détails télécharger les documents ci-dessous:
Liens de téléchargement des cours sur les liaisons covalentes
Cours sur liaison covalente N°1
Cours sur liaison covalente N°2
Cours sur liaison covalente N°3
Cours sur liaison covalente N°4
Cours sur liaison covalente N°5
Cours sur liaison covalente N°6
Liens de téléchargement des exercices corrigés sur les liaisons covalentes
Exercices corrigés sur liaison covalente
wonderful article
I truly appreciate your piece of work, Great post.