
Calorimétrie – Cours – TP -Exercices corrigés
La calorimétrie est la partie de la thermodynamique qui a pour objet la mesure des quantités de chaleur. On utilise pour cela un calorimètre.
Ce sont les quantités de chaleur nécessaires pour augmenter la température d’un corps, pour changer son état, ou bien encore les quantités de chaleur cédées par un corps qui refroidit (ou qui passe de l’état gazeux à l’état liquide ou encore de l’état liquide à l’état solide)
I- Calorimètre
Un calorimètre est un système thermodynamique isolé qui n’échange aucune énergie avec le milieu extérieur (ni travail W = 0, ni chaleur Q =0), cela implique que la somme des chaleurs échangées Qi au sein du calorimètre est nulle.
Les expériences ont lieu dans une enceinte suffisamment isolé pour éviter (pendant un laps de temps raisonnable) les échanges de chaleur avec l’extérieur. Cette enceinte est appelée un calorimètre. Les Américains emploient le terme « coffee-cup calorimeter » par analogie avec les mugs en carton avec couvercle dans lesquels ils boivent le café (si vous avez été dans une célèbre chaîne de café américaine, vous avez du boire dans de tels mugs, voir figure ci-dessous).
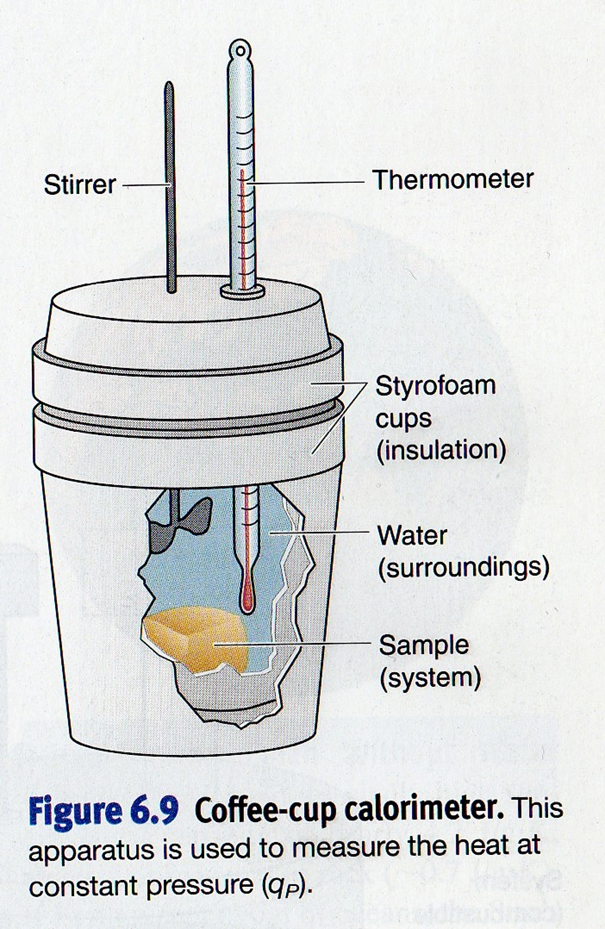
L’enceinte intérieure et les accessoires du calorimètre (agitateur et thermomètre) interviennent dans les échanges thermiques, puisque leur température varie de la valeur initiale à la valeur finale.
On définit la valeur en eau µ du calorimètre comme la masse d’eau qu’il faudrait ajouter en début d’expérience pour ne pas avoir à tenir compte du calorimètre dans l’équation calorimétrique. Si Ccal est la capacité thermique en J.K-1 du calorimètre et ce, mas la capacité thermique massique de l’eau en J.K-1.kg-1, alors :
Ccal = µce, mas avec µ = 15±1 g.
II- Valeur en eau d’un calorimètre
En calorimétrie, la valeur en eau (ou équivalent en eau) d’un corps est la masse d’eau fictive μ qui a la même capacité thermique que le corps.
Soit :
- Cm : capacité thermique du corps exprimé en J/°K
- Ceau : chaleur massique de l’eau ; soit 4185 J/kg°K
Alors la valeur en eau est donnée par :
\mu { C }_{ eau }={ C }_{ m }==>\quad \mu =\frac { { C }_{ m } }{ { C }_{ eau } } III- Exemple
Un calorimètre adiabatique contient 1 l d’eau à 15 °C. On verse dans ce calorimètre un autre litre d’eau à 60 °C. La température finale est de 35 °C. Calculer la valeur en eau du calorimètre.
Solution :
(μ c +m1c1)(tf – t1) + m2 c2 (tf – t2)=0
m1 = m2 = m
c1=c2 = c = 4,185 j/g°c (même liquide H2O)
(μ c +mc)(tf – t1) + m c (tf – t2)=0
μ (tf – t1) = m (t2 – tf) – m(tf – t1)
\mu =m.\frac { { t }_{ 2 }-{ t }_{ f } }{ { t }_{ f }-{ t }_{ 1 } } -m\quad =\quad \rho v(\frac { { t }_{ 2 }-{ t }_{ f } }{ { t }_{ f }-{ t }_{ 1 } } -1)AN : μ = 250 g
Pour plus de détails télécharger les documents ci-dessous:
Liens de téléchargement des cours sur la Calorimétrie
Cours sur la Calorimétrie N°1
Cours sur la Calorimétrie N°2
Cours sur la Calorimétrie N°3
Cours sur la_Calorimétrie N°4
Cours sur la_Calorimétrie N°5
Cours sur la Calorimétrie N°6
Liens de téléchargement des TP sur la Calorimétrie
TP sur la Calorimétrie N°1
TP sur la Calorimétrie N°2
TP sur la Calorimétrie N°3
TP sur la Calorimétrie N°4
Liens de téléchargement des exercices corrigés sur la Calorimétrie
Exercices corrigés sur la Calorimétrie N°1
Exercices corrigés sur la Calorimétrie N°2
Exercices corrigés sur la Calorimétrie N°3
Exercices corrigés sur la Calorimétrie N°4
Some truly nice and useful info on this site, besides I think the pattern contains great features. Cristina Hubey Hyacinthe
Excellent, what a web site it is! This website gives valuable data to us, keep it up. Traci Nilson Missie