
Electrolyse : Cours et Exercices corrigés PDF
L’électrolyse (une transformation forcée) est un phénomène chimique lié au passage du courant électrique dans une solution ionique.
I. Principe d’Electrolyse
L’électrolyse d’un liquide conducteur consiste à faire circuler un courant entre deux électrodes :
- l’anode (reliée) à la borne +
- la cathode reliée à la borne –
Le passage du courant provoque la rupture de liaisons et de nouveaux produits apparaissent aux électrodes.
I-1. La cuve à électrolyse : récepteur électrique
La cuve à électrolyse se comporte comme un récepteur électrique. C’est-à-dire que c’est un dipôle qui absorbe de l’énergie électrique.
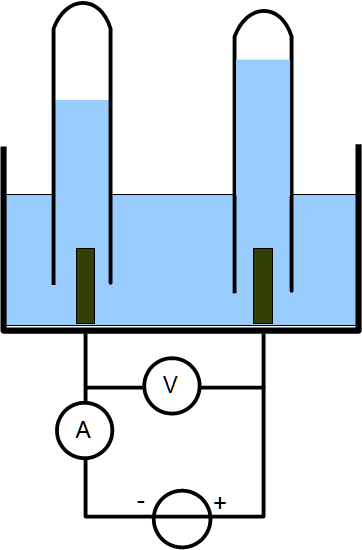
Le bilan énergétique est une transformation d’énergie électrique en énergie chimique.
Du point de vue électrique la tension aux bornes de la cuve varie avec l’intensité qui la traverse selon l’équation :
U = E’ + r’.I
I-2. Réactions chimiques
Les réactions chimiques qui se produisent aux électrodes sont des réactions d’oxydoréduction. On a une réduction à la cathode et une oxydation à l’anode. Les produits obtenus aux électrodes dépendent des espèces chimiques présentes dans l’électrolyte.
Dans l’eau les couples oxydant / réducteur existants sont : H+ / H2 et H2O /O2
I-3. Identification des gaz
- dihydrogène : petite explosion lors de la présentation d’une flamme.
- dioxygène : rallume une bûchette incandescente
- dioxyde de carbone : éteint une flamme
II. . Applications
II.1 Galvanometrie :
Elle consiste en la reproduction d’objets à partir d’une moule celui-ci sert de cathode. On prend une empreinte de cet objet pour que ce moule puisse servir de cathode on le rend conducteur en métallisant sa surface. Le moule se recouvre ainsi d’un dépôt peu adhérent qu’on détache par la suite. Dans ce cas c’est généralement du cuivre qui est déposé.
Un procédé de ce genre est utilisé pour fabriquer des clichés d’imprimerie permettant la reproduction de figure, et pour fabriquer des médailles ou des disques.
II.2 Affinage :
De nombreux métaux (argent, or, étain, nickel, chrome, cuivre …) peuvent être déposés par électrolyse sur un support métallique.
Le principe est celui d’une électrolyse à anode soluble ; l’anode est constituée par le métal à déposer et l’électrolyte est un sel de ce métal auquel on adjoint divers produits destinés à améliorer la qualité de l’adhérence du dépôt.
II.3. Galvanostegie :
Elle est l’opérateur qui consiste à former une couche métallique mince sur un objet soit pour le protéger de la corrosion, soit pour améliorer son esthétique.
II-4. La recharge de l’accumulateur
Une application très courante de l’électrolyse est la recharge de l’accumulateur.
Un accumulateur est capable de fonctionner en pile (décharge) ou en électrolyseur (charge). Dans un accumulateur, les réactions aux électrodes sont inversables : les réactions traduisant la charge et la décharge sont inverses l’une de l’autre.
Pour plus de détails télécharger les documents ci-dessous:
Liens de téléchargement des cours sur l’Electrolyse
Cours sur l’Electrolyse N°1
Cours sur l’Electrolyse N°2
Cours sur l’Electrolyse N°3
Cours sur l’Electrolyse N°4
Cours sur l’Electrolyse N°5
Cours sur l’Electrolyse N°6
Cours sur l’Electrolyse N°7
Cours sur l_Electrolyse N°8
Liens de téléchargement des exercices corrigés sur l’Electrolyse
Exercices corrigés sur l’Electrolyse N°1
Exercices corrigés sur l’Electrolyse N°2
Exercices corrigés sur l’Electrolyse N°3
Liens de téléchargement des TP sur l’Electrolyse
TP sur l’Electrolyse N°1
TP sur l’Electrolyse N°2
Just beneath, are many entirely not connected websites to ours, having said that, they may be certainly worth going over. Carola Micky Xanthus